Chaleur sensible et chaleur latente de vaporisation
Sommaire
Qu'est-ce que la chaleur sensible, la chaleur latente, la chaleur latente de vaporisation ? La chaleur latente et la chaleur sensible sont deux types de transfert de chaleur entre un objet et son environnement. La chaleur latente est la quantité de chaleur ajoutée à une substance ou retirée de celle-ci pour produire un changement de phase.
L'enthalpie de vaporisation
L'eau se met en ébullition à 100 °C sous la pression d'une atmosphère. L'enthalpie de vaporisation spécifique de l'eau, égale à la quantité de chaleur fournie pour transformer 1 kg d'eau en phase liquide en vapeur, est de 2 257 kJ/kg.
La chaleur sensible
La chaleur sensible modifie la température d'une matière. Par exemple : La chaleur thermique massique de l'eau est en moyenne de 4,19 kJ/kg.K, il faut donc fournir 419 kJ pour chauffer un litre d'eau de 0°C à 100°C.
La chaleur latente
La chaleur latente modifie l'état physique d'une matière solide, liquide ou gazeuse par opposition à la chaleur sensible qui modifie la température d'une matière.
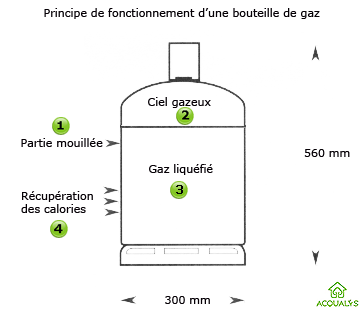
Fonctionnement de la chaleur latente de vaporisation : sur le schéma ci-dessus, la coupe de la bouteille de gaz montre la partie mouillée (1) c'est à dire le niveau de remplissage de gaz liquéfié à 85 % (3) en contact avec la paroi du récipient. Lorsque l'on ouvre le robinet pour l'utilisation, le gaz passe de la phase liquide à une phase gazeuse dans la zone 2 appelée ciel gazeux.
Un gaz qui se détend en passant de liquide à gazeux produit du froid, la paroi mouillée sert d'échange thermique entre intérieur et extérieur. Un niveau de température suffisant extérieur (4) est nécessaire pour assurer cette transformation appelée ébullition (zéro degré pour le butane et moins 42 ° pour le propane). Plus la surface d'échange est importante et plus le gaz pourra se vaporiser, c'est la raison pour laquelle des réservoirs de gaz sont utilisés en raison de leur taille qui augmente la surface mouillée.
La capacité d'évaporation est fonction de cette surface d'échange, de la température extérieure et du débit de gaz exprimé en grammes/heure ou Kg/heure demandé par l'appareil de service (chaudière, réchaud, barbecue, désherbeur, etc.).
Principe de vaporisation du gaz
La chaleur latente de vaporisation
Voici 2 exemples sur le gaz et sur l'eau
Exemple pour le gaz
Lors de l’ouverture du robinet d’une bouteille de butane ou propane, le gaz s'échappe et au fur et à mesure le ciel gazeux (la partie haute de la bouteille) est remplacé par du nouveau gaz produit par le gaz liquide qui s’évapore. Cette phase s'appelle l'ébullition, cette évaporation demande de la chaleur. La chaleur latente de vaporisation est la quantité de chaleur qu’il faut apporter par unité de masse à un corps pur liquide pour l’obtenir à l’état gazeux à la même température sous pression constante.
Le débit de gaz augmente, lorsque la quantité de chaleur augmente, la masse du liquide subit une diminution de température car l’évaporation va récupérer de la chaleur (calories) dans la masse même du liquide, ce qui fait provoque une baisser de sa température.
Lorsque le débit est peu important et la température de l’air ambiant élevée, la différence de température entre l’extérieur et l’intérieur permet un apport suffisant de chaleur (calories) au travers de la parois mouillée (baignée intérieurement par le liquide).
Lorsque le débit de gaz demandé par l'appareil de service est important et la température ambiante basse, l’apport de chaleur sera insuffisant. La température de la masse liquide du gaz baissera progressivement jusqu’à atteindre ( - 42° C) pour le gaz propane et (-0,5°C) pour le gaz butane. Les bouteilles ne pourront plus débiter lorsqu'elles atteignent leur température limite, les parois des récipients givrent. Le propane est plus efficace en hiver le butane.
Deux exemples de chaleur latente de vaporisation à + 15° C :
- PROPANE = 356 kJ
- BUTANE = 362 kJ
Exemple pour l'eau
la chaleur de vaporisation varie en fonction de la température de l'eau qui s'évapore : de 2 257 kJ/kg à 100°C, la chaleur de vaporisation est de 2 454 kJ/kg à 20°C et de 2 501 kJ/kg à 0°C.
La chaleur de liquéfaction
La chaleur de liquéfaction est la chaleur nécessaire pour passer de l’état solide à l’état liquide.

La chaleur de vaporisation
La chaleur de vaporisation est la chaleur nécessaire pour passer de l’état liquide à l’état gazeux.
Exemple : la chaleur de vaporisation d'un litre d'eau est de 2 257 kJ/kg (à la pression atmosphérique et à une température de 100°C).
La chaleur de condensation
La chaleur de condensation est la chaleur nécessaire pour passer de l’état gazeux à l’état liquide. La chaleur latente de condensation est la quantité de chaleur exprimée en Joule/kilogramme (J/kg)qu'il faut extraire à 1 kg de vapeur saturée (à pression et température constantes) pour obtenir 1 kg d'eau.
La chaleur de solidification
La chaleur de solidification est la chaleur nécessaire pour passer de l’état liquide à l’état solide.
Recherche de mots clefs dans les articles
Un additif gaz peut-il créer des problèmes aux organes de détente
Une question est fréquemment posée par des particuliers et professionnels qui constatent parfois que les DDS (Déclencheurs De Sécurité) placés en amont des appareils de service (chaudière gaz, chauffe-eau ou table de cuisson) ont les filtres obturés par des éléments noirâtres ou des paillettes....
Conversion m3 gaz compteur ITRON G6RF1 raccordé à une cuve propane
Le compteur Itron RF1 G6 est un compteur à membranes conçu pour mesurer le volume de divers gaz : naturel, propane, butane....
Coefficient de conversion pour convertir 1 m³ de gaz naturel en kWh
Une facture de gaz naturel indique une consommation qui n’est pas exprimée en mètres cubes (m³), comme sur le compteur, mais en kilowattheures (kWh)....
Arrêté du 2 août 1977 : règles de sécurité des installations gaz logements
L’arrêté du 2 août 1977 est la référence en matière de sécurité des installations de gaz dans les logements....
Principales dates de modification de l'arrêté gaz du 2 août 1977
L’arrêté du 2 août 1977 est un pilier de la réglementation gaz en France qui a demandé un énorme travail pour le structurer....
Entretenir une citerne de gaz propane : le guide complet
Les citernes comme les bouteilles de gaz propane font partie des équipements manufacturés les plus fiables conçus pour durer plusieurs décennies....
Débit d'une citerne de gaz propane Quelle puissance y raccorder ?
Lorsque l'on veut chauffer son logement au gaz sans être raccordé au réseau canalisé de gaz naturel l'option réservoir GPL est possible....
Additif hivernal pour citerne de gaz propane GPL bio méthanol
Les détentes des appareils fonctionnant au gaz sont sensibles aux températures basses. Des additifs sont donc incorporés au propane afin de permettre une évaporation correcte du gaz propane car le GPL (gaz de pétrole liquéfié) contenu dans un réservoir est composé d’un mélange de gaz butane et propane.
Quelles sont les règles pour entreposer du gaz GPL bouteille ou cuve ?
L'entreposage du gaz GPL (gaz de pétrole liquéfié), que ce soit sous forme de bouteille ou de cuve, est soumis à des règles de sécurité strictes pour éviter tout danger lié à la manipulation de gaz inflammables....
Citerne de gaz propane Questions réponses techniques sur le GPL
Questions réponses techniques sur le GPL gaz de Pétrole Liquéfié....
Arrêté du 23 février 2018 normes installations appareils gaz
Arrêté du 23 février 2018 relatif aux règles techniques et de sécurité applicables aux installations de gaz combustible gaz naturel ou gaz propane) des bâtiments d’habitation individuelle ou collective, y compris les parties communes. L'arrêté du 23 février 2018 structuré en 8 titres et 5 annexes est complété par un guide général et 4 guides thématiques. Vous pouvez nous le demander en fichier PDF.
Pourquoi utiliser le gaz propane plutôt que le gaz butane ?
Quelle est la différence entre le propane et le butane ? Le gaz butane et un GPL commercialisé sous forme liquide comme le gaz propane ne s'évapore plus en dessous de +2 °C. La vaporisation du propane en théorie* peut s'opérer même lorsque les températures passent atteignent -44 °C.
Règles de transport gaz Catégorie 1 2 3 butane propane dans un véhicule
Le règlement des transports de matières dangereuses par route est soumis à l'ADR (Accord européen relatif au transport international des matières dangereuses par Route)....
Installation chaudière gaz de puissance de plus de 70 KW en cave
Est-il possible d'installer une chaudière gaz dans une cave ou un demi-sous-sol ?...
Gaz propane en citerne La distance par rapport à un arbre
Les consommateurs sont exposés aux évolutions des cours des matières premières ainsi que des obligations vis-à-vis des réseaux de distribution d'énergie, etc....
Tableau de calcul de dimensionnement des canalisations de gaz
Le dimensionnement des canalisations de gaz dépend de plusieurs facteurs, tels que le débit de gaz, la pression, la longueur de la canalisation, le type de gaz transporté, etc....
Contrôle installations gaz : rôle et démarches avec Qualigaz Evonia
Pour l'électricité, le Consuel est le contrôle de la conformité de l'installation électrique et pour le gaz l'association Qualigaz est chargée de ce contrôle de conformité....
Changer de gaz : propane ou gaz naturel ? Différences et adaptation
Est-il possible de remplacer le propane par du gaz naturel ou inversement ?...
Normes repérage couleur identification gaz naturel-propane
Les canalisations peuvent être repérées soit avec de la peinture, soit à l'aide de bandes adhésives ou tout autre moyen....
Ventilation grille air obligatoire appareil gaz non raccordé
En habitation, quelle ventilation faut-il prévoir dans un local comportant un appareil de type A ? comme une plaque de cuisson, une gazinière ou tout autre appareil fonctionnant au gaz NON RACCORDE (c'est-à-dire qu'il n'est pas raccordée à une cheminée qui évacue les gaz brûlés à l'extérieur).
Robinet d'arrêt pour appareil de cuisson Gaz naturel ou GPL
Pendant des décennies, dans les cuisines alimentées par le gaz naturel ou du gaz de pétrole liquéfié distribué par réseau, un robinet à extrémité soudée (about soudé et annelé) ou tétine, était installé à l'arrivée du gaz. Un tuyau (tube) souple en caoutchouc s’emboîtait dessus, sa durée de vie était de 5 ans.
Tuyau de gaz à proximité d'un four Existe-t-il un danger ?
Le cuisiniste vient d'installer une nouvelle cuisine et a placé une bouteille de gaz dans le meuble. La question souvent posée est liée au passage du tuyau de gaz à proximité du four dont la température peut atteindre 250 degrés. En raison de la forte inflammabilité du butane cette installation présente-t-elle un danger pour un tuyau de gaz en caoutchouc ou en inox ?
Tuyauterie de gaz : les prescriptions à respecter
Toutes les prescriptions à respecter lors de la pose d'une tuyauterie de gaz après compteur dans une cloison sont détaillées dans la NF DTU 61.1 P2. Découvrez ces conditions et à qui faire appel pour une installation de gaz.
Réglementations et normes professionnels installations gaz
Des textes relatifs à la réglementation du gaz s'appliquent aux bâtiments d'habitation (individuels et collectifs), aux établissements recevant du public (1er et 2ème 3ème 4ème groupe) ainsi qu'aux immeubles de bureaux....
Nature des tuyauteries de gaz et dimensionnement
Une installation d'un appareil à gaz (chaudière, chauffe-eau, radiateur, ballon à accumulation, etc....
QMOS Qualification de Mode Opératoire de Soudage
QMOS (Qualification de Mode Opératoire de Soudage) désigne l'opération de soudage par fusion sur un acier utilisé pour la fabrication d'une structure. Certaines soudures doivent être effectuées par des techniciens spécialistes de la tuyauterie.
Gaz propane : Contrôle d'étanchéité des installations de gaz
Le contrôle et la réception des installations de GPL est obligatoire avant la mise en service d'une installation gaz ou d'un complément d'installation gaz comportant des tuyauteries fixes, lorsque ce complément d'installation a été porté à sa connaissance, le distributeur de gaz doit se faire présenter le ou les certificat (s) d'installation (s) et s'assurer que ces documents concernent la totalité de l'installation en cause.
Comment convertir m3, litres et kg de gaz propane en kWh
Comment faire la conversion de m3 de gaz en kWh. Convertir des m3 relevés à un compteur de gaz en kilos (kg) ou en tonne de gaz propane. Convertir des m3 gaz propane en litres kWh poids/ kg/ tonne. Comment transformer des litres de gaz avec un coefficient de transformation et un poids en kilos lorsque le livreur a laissé un bon de livraison qui indique des litres.
Chaleur sensible et chaleur latente de vaporisation
Qu'est-ce que la chaleur sensible, la chaleur latente, la chaleur latente de vaporisation ? La chaleur latente et la chaleur sensible sont deux types de transfert de chaleur entre un objet et son environnement. La chaleur latente est la quantité de chaleur ajoutée à une substance ou retirée de celle-ci pour produire un changement de phase.
Règles d'implantation des conduits d'évacuation gaz brûlés
L’arrêté du 22 octobre 1969 relatif aux conduits de fumée donne les indications pour tous les combustibles à tirage naturel. AG.8, 241 et AG 11,35. 1. Pour une toiture dont la pente est au moins égale à 15 °, la hauteur du débouché doit dépasser le faitage de 40 cm (au-dessus de toute construction distante de moins de 8 mètres). La norme NF DTU 24.1 a été aménagée en octobre 2020, elle comporte des modifications